Donatoren in Indiumantimonid (InSb)
Bestimmung der Ionisierungsenergie der Donatoren und des Bahnradius für den Grundzustand in Indiumantimonid

Brechung im Glaswürfel
Ein Würfel aus Glas hat in seiner Mitte eine kleine Fliege eingeschlossen. Welche Teile des Würfels müssen bedeckt werden, damit die Fliege nicht mehr sichtbar ist?
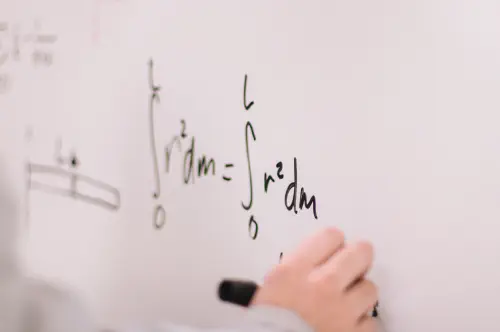
Normierte vollständige Eigenfunktionen eines Elektrons im Coulombpotential
Übersicht der normierten vollständigen Eigenfunktionen eines Elektrons im Coulombpotential.
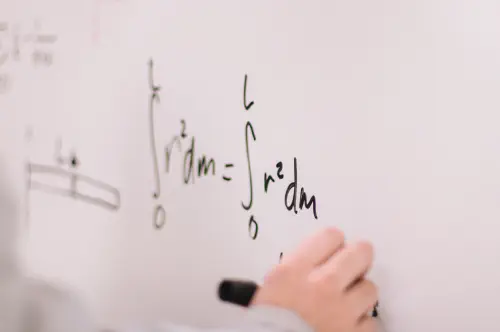
Potential von Metallen in eindimensionaler Näherung
Betrachtung der Reflexions- und Transmissionswahrscheinlichkeiten von Elektronen an der Grenze zwischen Metall und Vakuum in eindimensionale Näherung.
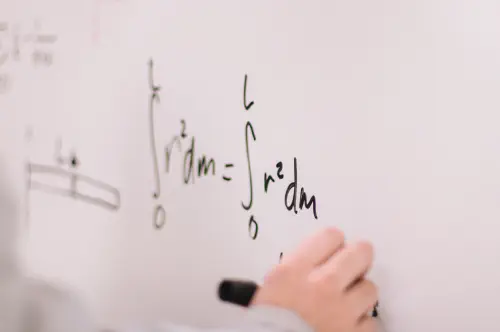
Räumliche Aufenthaltswahrscheinlichkeitsdichte des Elektrons im Wasserstoffatom
Graphische Darstellung der räumlichen Aufenthaltswahrscheinlichkeitsdichte des Elektrons im Wasserstoffatom

Beispiel zur Fata Morgana
In der folgenden Betrachtung soll das folgende Beispiel zur Fata Morgana berechnet werden.